| Ecuación de Van der Waals |
Para
un gas ideal, se cumple la ley: P V = n R T, donde V es el volumen de
gas, P la presión, n el número de moles del gas, R la constante
universal de los gases y T es la temperatura en grados Kelvin.
Si los gases fueran ideales el producto P V debería ser constante a
todas las presiones, pero todos los gases se desvían de este
comportamiento en la mayor parte de las condiciones. Generalmente, la
curva P V en función de P de un gas real pasa por un mínimo. En los
gases muy ligeros, como hidrógeno y helio, y en todos los gases a
temperaturas muy superiores al punto de ebullición, no se observa este
mínimo. En todos los gases existe una temperatura conocida como
temperatura de Boyle en la que desaparece el mínimo de la curva P V =
f(P). Sin embargo, el mínimo se hace muy visible cerca de la temperatura
de condensación.
Se han propuesto distintas ecuaciones para predecir el comportamiento de
gases reales. La más conocida es la ecuación de Van der Waals. Esta es
una ecuación de estado para gases reales que tiene en cuenta las fuerzas
de atracción y repulsión entre las moléculas. Así, se transforma la
ecuación de los gases ideales, P V = n R T, en:
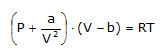
donde
V es el volumen de un mol. Los valores a y b pueden determinarse a
partir de las constantes críticas de los gases.
La siguiente herramienta permite obtener V, conocidos P y T para un
determinado gas utilizando la ecuación de Van der Waals. Los gases
utilizados en la aplicación son: nitrógeno, oxígeno, dióxido de carbono,
amoníaco, etileno y dióxido de azufre.
Se utiliza el método de Newton para hacer los cálculos, y se elige para
iniciar las iteraciones el valor que se obtiene utilizando la ecuación
de los gases ideales corregida:
![]()